粒線體在癌症中的雙重角色
粒線體是細胞的能量工廠,負責產生ATP,對細胞的生存至關重要。粒線體功能失調會導致能量短缺和過多的氧化物(ROS)積累,損害細胞。過去的研究已知,靠近神經的腫瘤生長速度更快,且細胞之間能夠相互轉移粒線體,例如星狀膠質細胞會將轉移粒線體給受損的神經元,幫助它存活。不過,癌細胞與神經元、免疫細胞之間是否存在粒線體交換,一直是個未解之謎。
神經元為癌細胞供能:粒線體轉移增強轉移性
Mitchell Cancer Institute 的研究團隊透過綠螢光蛋白 eGFP 和自己開發的 MitoTRACER 去標記和追蹤粒線體的動向,發現粒線體的確會在神經元和癌細胞之間轉移。由於 eGFP 在進入接收的細胞後,亮度會掉很多,所以他們開發可以永久標記粒線體轉移的 MitoTRACER,被紅螢光蛋白 mCherry 的癌細胞在接受了神經細胞轉移過來的粒線體後,mCherry 會被移除,並會永久表現 eGFP。
▫️ 增強癌細胞代謝:與神經元共同培養後,癌細胞的粒線體呼吸率顯著提高。有趣的是,與癌細胞一起培養的神經元,其粒線體量也大幅增加。
▫️ 粒線體的轉移途徑:癌細胞和神經元之間的通道:當他們用螢光蛋白 eGFP 去標記神經元的粒線體,然後將它和將乳癌細胞培養在一起,結果發現神經元和癌細胞之間會形成一個奈米通道(tunnelling nanotube),神經元的粒線體會穿過那個通道跑到乳癌細胞中。
他們也基因改造了老鼠,使牠肚子脂肪裡的神經元也帶有 eGFP 標記的粒線體,然後再把癌細胞打進脂肪中。三個禮拜後,有些癌細胞出現了螢光粒線體。
▫️ 功能恢復與增生:粒線體恢復缺陷癌細胞功能:當他們基改癌細胞,使它們缺少粒線體,讓他們不會分裂,耗氧量也很低,表示代謝有問題。不過,把它們和神經細胞一起培養五天後,這些癌細胞就恢復代謝功能了,也開始增生,表示它們可能從附近的神經細胞中獲得了功能正常的粒線體。
在老鼠和人類身上也觀察到粒線體轉移對癌症的影響:
- 在老鼠身上:他們利用 MitoTRACER 追蹤在老鼠體內的粒線體動向,發現雖然原位瘤中只有約 5% 的癌細胞獲得了神經細胞的粒線體,但在轉移到肺部和腦部的癌細胞中,粒線體的比例例分別飆升至 27% 和 46%。也就是說,粒線體轉移大幅增加了癌細胞的轉移能力。
- 在人體身上:分析人類前列腺腫瘤組織樣本也發現,越靠近神經的癌細胞,其粒線體的含量也越多。
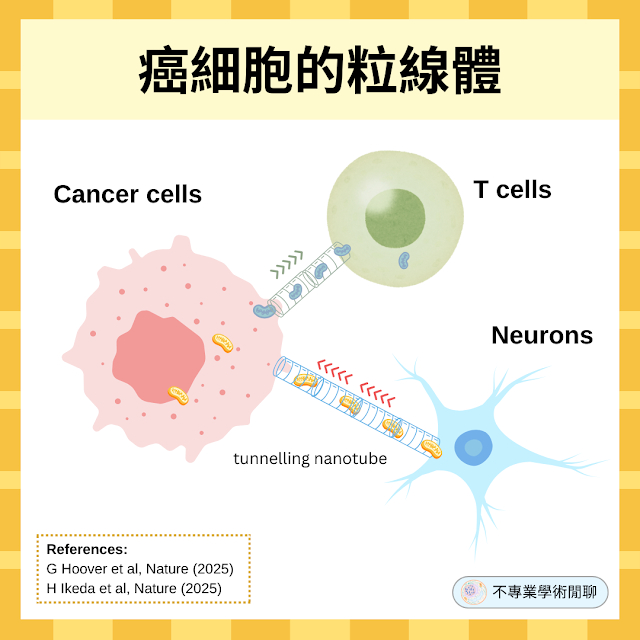
癌細胞將突變粒線體轉移給免疫 T 細胞以癱瘓其功能
癌細胞本身常帶有突變的粒線體 DNA (mtDNA),這會損害其能量生成。不只如此,在腫瘤微環境中,免疫 T 細胞內的粒線體也有功能失調,而這是導致 T 細胞耗竭、無法有效攻擊癌細胞的關鍵。不過,T 細胞的中粒線體會什麼會功能失調?
日本岐阜癌症研究中心的研究團隊從 12 名不同癌症類型的患者身上採集了腫瘤浸潤淋巴細胞的 T 細胞(Tumor-Infiltrating Lymphocytes, TILs),分析它們的粒線體 DNA (mtDNA)。除此之外,他們也用 MitoDsRed 去標記癌細胞的粒線體,也用 MitoTracker Green 去標示免疫 T 細胞的粒線體,藉以追蹤它們的動向。
▫️ 共享的粒線體突變:在 12 名患者中,有 5 名的 TILs 中被檢測到 mtDNA 突變,其中三位的 TILs 和癌細胞帶有相同的 mtDNA 突變。
▫️ 粒線體的單向轉移:癌細胞和 T 細胞在共同培養超過 24 小時後,免疫 T 細胞內出現了紅色螢光,表示癌細胞的確把自己的粒線體轉移給了免疫 T 細胞。
▫️ 完全取代:癌細胞和 T 細胞在共同培養 15 天後,部分 T 細胞內的粒線逐漸消失,被來自癌細胞的粒線體完全取代,也就是同質性替換(Replacement to Homoplasmy)。
粒線體轉移的秘密通道
他們用藥物來檢測粒線體是怎麼被轉移的,發現有兩個方式:
- 奈米通道(Tunnelling Nanotubes, TNTs):用藥物抑制奈米通道的形成,或使用物理隔板阻止細胞直接接觸,都能大幅減少粒線體的轉移,顯示透過 TNTs 進行的直接細胞接觸是主要途徑之一。
- 細胞外囊泡(extracellular vesicles, EVs):使用能阻斷 EVs 釋放的藥物,同樣能顯著減少轉移。另外,即便阻止了細胞間的直接接觸,藥物仍然讓轉移率變更低,他們也從純化出的 EVs 中發現了粒線體蛋白,顯示細胞外囊泡確實能攜帶粒線體。
粒線體失調的影響:為何免疫療法會失效?
免疫 T 細胞在接收了來自癌細胞的、帶有突變的粒線體後,其功能變被破壞了,包括新陳代謝失調、提早衰老、無法形成長期記憶,以及無法被活化以進行攻擊癌細胞的任務。
- 老鼠模型:在 T 細胞粒線體功能缺陷的老鼠中,PD-1 抑制劑的療效明顯減弱了。即使接受 PD-1 抑制劑治療,這些老鼠也無分像正常老鼠一樣增加具有攻擊力的 T 細胞。
- 人類臨床數據:腫瘤中帶有 mtDNA 突變的皮膚癌和肺癌患者(melanoma, NSCLC)在接受 PD-1 抑制劑治療後,其無惡化存活期(progression-free survival)和總體存活期(overall survival)都比沒有 mtDNA 突變的患者要短。
結論
總結來說,癌細胞展現了令人驚訝的精密策略:一方面從神經元竊取健康的粒線體來助長自身擴散,另一方面又將受損的粒線體轉移給T細胞,以摧毀免疫防線。這也太邪惡了吧!
這一發現也直接解釋了臨床上的難題。
由於健康的T細胞是 PD-1 抑制劑等免疫療法成功的基礎,癌細胞對 T 細胞粒線體的破壞,無疑是削弱免疫療效、導致治療失敗的關鍵因素之一。
☕️ 如果你喜歡這篇內容,歡迎賞一杯咖啡。😊
合作邀約: nonproscience@gmail.com
📍 文稿:科普文、公司文、產業文等等
📍 諮詢:實驗設計、加拿大研究所、生科產業
Articles:
Nature | Cells are swapping their mitochondria. What does this mean for our health?
Nature | Mitochondrial swap from cancer to immune cells thwarts anti-tumour defences
Tumours may get supercharged by acquiring powerhouses of nerve cells | Science | AAAS
Publications:
G Hoover, S Gilbert, Curley, O. et al. Nerve-to-cancer transfer of mitochondria during cancer metastasis. Nature (2025) DOI: 10.1038/s41586-025-09176-8
H Ikeda, K Kawasei, T Nish et al. Immune evasion through mitochondrial transfer in the tumour microenvironment. Nature (2025) DOI: 10.1038/s41586-024-08439-0




